新一批鼓勵(lì)仿制藥品目錄,,39種,!
關(guān)于印發(fā)第三批鼓勵(lì)仿制藥品目錄的通知
國衛(wèi)辦藥政函〔2023〕471號(hào)
各省、自治區(qū),、直轄市及新疆生產(chǎn)建設(shè)兵團(tuán)衛(wèi)生健康委,、工業(yè)和信息化主管部門,、知識(shí)產(chǎn)權(quán)局,、疾控局、藥監(jiān)局:
為落實(shí)國務(wù)院辦公廳《關(guān)于改革完善仿制藥供應(yīng)保障及使用政策的意見》和國家衛(wèi)生健康委等6部門《關(guān)于印發(fā)深化醫(yī)藥衛(wèi)生體制改革2023年下半年重點(diǎn)工作任務(wù)的通知》有關(guān)制定鼓勵(lì)仿制藥品目錄的部署和要求,,國家衛(wèi)生健康委聯(lián)合工業(yè)和信息化部,、國家知識(shí)產(chǎn)權(quán)局、國家醫(yī)保局,、國家疾控局,、國家藥監(jiān)局等部門組織專家對(duì)國內(nèi)專利即將到期及臨床供應(yīng)短缺(競(jìng)爭(zhēng)不充分)的藥品進(jìn)行遴選論證,制定了《第三批鼓勵(lì)仿制藥品目錄》?,F(xiàn)印發(fā)給你們,,請(qǐng)推動(dòng)相關(guān)工作開展。各相關(guān)部門要按照有關(guān)規(guī)定,,在臨床試驗(yàn),、關(guān)鍵共性技術(shù)研究、優(yōu)先審評(píng)審批等方面予以支持,。
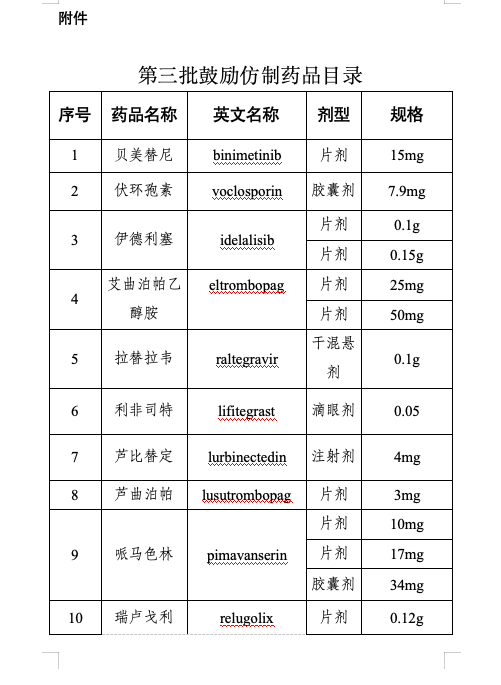
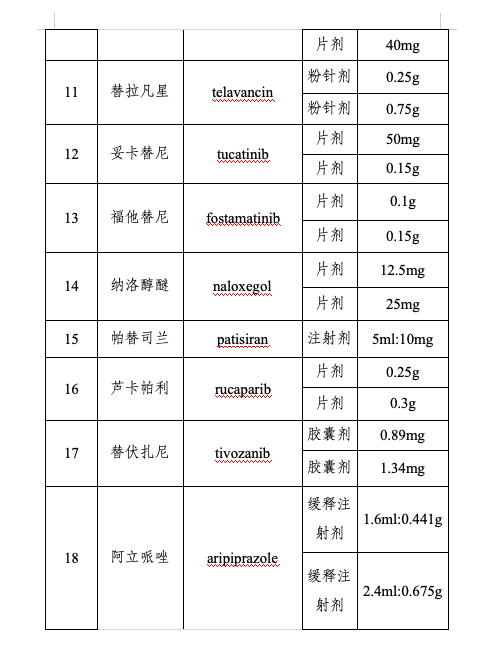
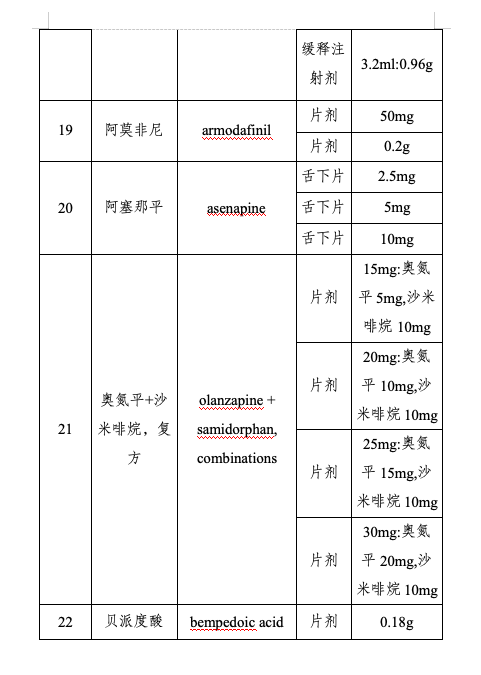
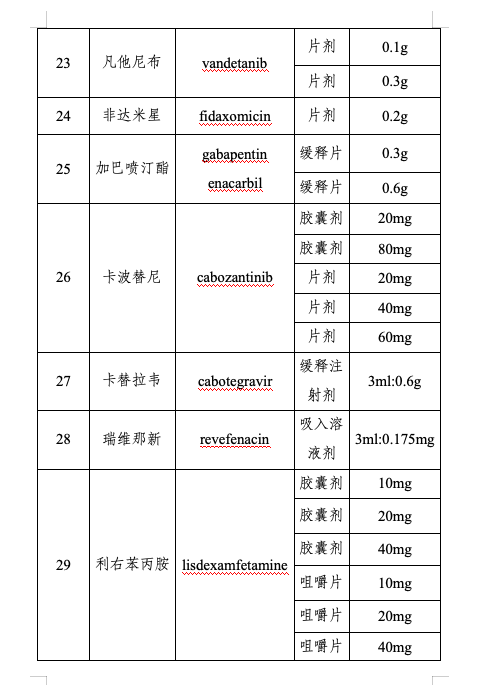
附件:第三批鼓勵(lì)仿制藥品目錄
國家衛(wèi)生健康委辦公廳
工業(yè)和信息化部辦公廳
國家知識(shí)產(chǎn)權(quán)局辦公室
國家疾控局綜合司
國家藥監(jiān)局綜合司
2023年12月20日
(信息公開形式:主動(dòng)公開)
《關(guān)于印發(fā)第三批鼓勵(lì)仿制藥品目錄的通知》政策解讀
一,、《第三批鼓勵(lì)仿制藥品目錄》主要特點(diǎn)
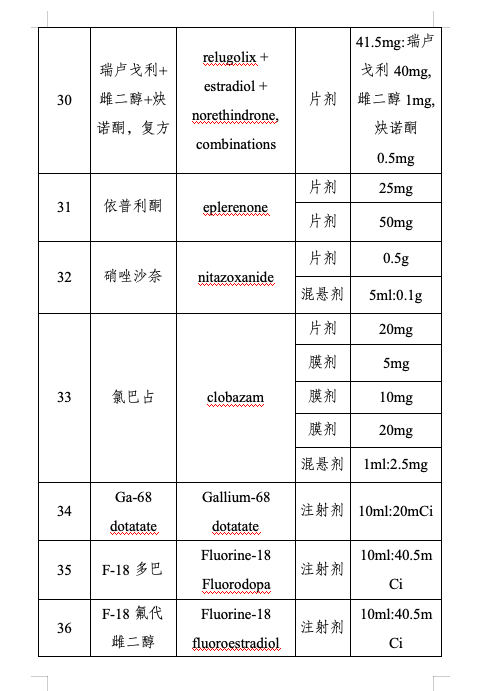
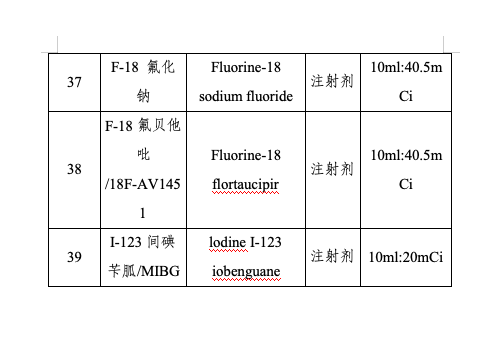
仿制藥是藥品供應(yīng)保障體系的重要組成部分。為進(jìn)一步提高我國藥品供應(yīng)保障能力,,更好地滿足人民群眾對(duì)高質(zhì)量仿制藥的需求,,國家衛(wèi)生健康委聯(lián)合工業(yè)和信息化部、國家知識(shí)產(chǎn)權(quán)局,、國家醫(yī)保局、國家疾控局,、國家藥監(jiān)局等部門組織專家對(duì)國內(nèi)藥品專利情況及臨床供應(yīng)短缺(競(jìng)爭(zhēng)不充分)的藥品進(jìn)行梳理遴選論證,,結(jié)合前兩批鼓勵(lì)仿制藥品目錄實(shí)施效果評(píng)估,綜合考慮臨床指南推薦、全球上市國家數(shù),、原料藥供應(yīng),、工藝開發(fā)難度,、國內(nèi)在研情況等因素,,擬定《第三批鼓勵(lì)仿制藥品目錄》(以下簡(jiǎn)稱第三批目錄),,并向社會(huì)公開征求意見后按程序印發(fā)實(shí)施,。第三批目錄收錄39個(gè)品種,,涉及75個(gè)品規(guī),、13種劑型,覆蓋抗腫瘤藥及免疫調(diào)節(jié)劑,、抗感染用藥,、神經(jīng)系統(tǒng)用藥、放射性診斷劑,、心血管系統(tǒng)用藥等12個(gè)方面治療用藥,。
第三批目錄主要有三個(gè)特點(diǎn):一是覆蓋疾病領(lǐng)域范圍廣。第三批目錄所收錄藥品是我委組織多部門,、多學(xué)科專家遴選論證產(chǎn)生,,采取藥品信息梳理、專業(yè)科別咨詢,、劑型規(guī)格逐一討論和專家獨(dú)立投票等多種形式,,充分聽取臨床、藥學(xué),、公共衛(wèi)生,、藥品審評(píng)、知識(shí)產(chǎn)權(quán)等方面專家意見,,收錄藥品包括抗腫瘤,、傳染病治療及放射性診斷等藥物,收錄混懸劑等兒童適宜劑型,。二是重視與參比制劑備案信息的協(xié)同,。第三批目錄藥品在劑型規(guī)格遴選上審慎參考國家藥品監(jiān)督管理部門發(fā)布的仿制藥參比制劑目錄,收錄藥品多為已有參比制劑的品種,,提升企業(yè)仿制效率。三是兼顧企業(yè)研發(fā)積極性,。第三批目錄遴選過程中,,通過數(shù)據(jù)分析和專家論證等方式綜合評(píng)估了藥品的臨床應(yīng)用前景、生產(chǎn)工藝難度和潛在市場(chǎng)空間,提升企業(yè)仿制可行性,。
二,、《第三批鼓勵(lì)仿制藥品目錄》滿足的臨床用藥需求
第三批目錄以臨床用藥需求為導(dǎo)向,豐富臨床用藥選擇,,提升臨床用藥質(zhì)量,。一是填補(bǔ)國內(nèi)臨床用藥空白。第三批目錄收錄的多個(gè)藥品為境外已上市,,境內(nèi)未上市品種,,是該治療領(lǐng)域的全球首個(gè)藥物,具有全新的作用機(jī)制,。如治療成人遺傳性轉(zhuǎn)甲狀腺素介導(dǎo)的淀粉樣變性的多發(fā)性神經(jīng)病的小干擾RNA藥品帕替司蘭,,聯(lián)合免疫抑制劑治療成人活動(dòng)性狼瘡腎炎的口服藥品伏環(huán)孢素等。二是提高藥品可及性,。第三批目錄收錄的部分藥品,,雖然同作用機(jī)制藥品已經(jīng)在境內(nèi)上市,,但由于臨床需求量大,,存在供應(yīng)短缺的風(fēng)險(xiǎn),因此也納入鼓勵(lì)仿制的范圍,,滿足臨床用藥可及,。三是鼓勵(lì)創(chuàng)新制劑技術(shù),。第三批目錄收錄的藥品劑型除了有傳統(tǒng)的片劑,、膠囊劑外,還收錄了緩釋注射劑,、干混懸劑,、舌下片等新型藥物制劑,以及兒童適宜的劑型和新的復(fù)方制劑,,更好滿足不同患者的用藥需求,,提高患者適宜性。四是提高臨床診斷準(zhǔn)確性,。第三批目錄收錄了6個(gè)放射性藥品,,可用于影像學(xué)的診斷和定位,均為境內(nèi)未上市藥品,,對(duì)于及時(shí)確診疾病及病程意義重大,。
三、鼓勵(lì)仿制藥品目錄遴選的主要考慮
鼓勵(lì)仿制藥品目錄的遴選綜合考慮臨床用藥的必需性和企業(yè)研發(fā)的可行性,。一是堅(jiān)持臨床需求為導(dǎo)向,。充分考慮現(xiàn)階段和今后一段時(shí)期的基本國情,,突出臨床價(jià)值導(dǎo)向,以近年來境外已上市,,境內(nèi)未上市的仿制藥品信息為基礎(chǔ),,梳理藥品適應(yīng)癥、治療領(lǐng)域,、相關(guān)疾病主要臨床用藥指南推薦等信息進(jìn)一步匹配臨床需求,,再梳理國內(nèi)相關(guān)藥品專利情況,重點(diǎn)關(guān)注臨床必需,、療效確切的藥品,,包括重大傳染病防治和罕見病治療所需藥品等。二是兼顧企業(yè)研發(fā)可行性,。我委聯(lián)合相關(guān)部門成立遴選工作組,,組織專家共同研究論證,綜合考慮藥品國內(nèi)研發(fā)現(xiàn)狀,、生產(chǎn)工藝難度,、原料藥供應(yīng)、專利侵權(quán)風(fēng)險(xiǎn),、參比制劑目錄等因素。
四,、前兩批《鼓勵(lì)仿制藥品目錄》實(shí)施情況
國家衛(wèi)生健康委聯(lián)合相關(guān)部門已先后發(fā)布2批《鼓勵(lì)仿制藥品目錄》,,對(duì)目錄內(nèi)藥品的研發(fā)上市起到了有效的鼓勵(lì)與引導(dǎo)作用。目前,,目錄內(nèi)33個(gè)品種已獲批上市,,覆蓋抗感染用藥、抗腫瘤藥及免疫調(diào)節(jié)劑,、神經(jīng)系統(tǒng)用藥等15個(gè)方面治療用藥,,其中包含7個(gè)罕見病用藥。主要有以下成效:
一是有序引導(dǎo)企業(yè)研發(fā),,保障用藥可及,。前2批目錄中已上市藥品中的多個(gè)品種為目錄發(fā)布后首次在境內(nèi)獲批上市。如,,曲前列尼爾注射劑等已有國產(chǎn)藥品首次獲批上市,,格拉替雷注射液等已有進(jìn)口藥品首次獲批上市,艾替班特注射液等已有國產(chǎn)和進(jìn)口藥品獲批上市,。
首次獲批上市的藥品含多個(gè)罕見病用藥,,如,治療Ⅰ型遺傳性酪氨酸血癥的尼替西農(nóng)膠囊等,;同時(shí),,也涉及呼吸系統(tǒng)用藥,、內(nèi)分泌及代謝用藥、抗感染用藥等常用藥領(lǐng)域,,如治療和預(yù)防侵襲性曲霉病的泊沙康唑注射液等。
二是引導(dǎo)形成充分市場(chǎng)競(jìng)爭(zhēng),,保障藥品供應(yīng),。前2批目錄已上市的33個(gè)品種中,3家及以上企業(yè)生產(chǎn)的品種15個(gè),,2家企業(yè)生產(chǎn)的品種6個(gè),,1家企業(yè)生產(chǎn)的品種12個(gè);目錄發(fā)布前已有上市藥品,,發(fā)布后有新增生產(chǎn)企業(yè)的品種9個(gè),。目錄的發(fā)布改善了臨床部分疾病無藥可用的現(xiàn)狀,豐富了常見治療領(lǐng)域的藥品選擇,,有效保障臨床藥品供應(yīng),。
三是與藥監(jiān)政策銜接,推動(dòng)臨床急需藥品快速上市,。為加快具有突出臨床價(jià)值的臨床急需藥品上市,,鼓勵(lì)仿制藥品目錄堅(jiān)持臨床需求導(dǎo)向,與藥監(jiān)政策銜接,,推動(dòng)目錄藥品的研發(fā)申報(bào),,激發(fā)企業(yè)研發(fā)生產(chǎn)動(dòng)力,促進(jìn)仿制藥品研發(fā),。前2批目錄中,,已有14個(gè)藥品通過納入優(yōu)先審評(píng)審批程序予以上市許可。
四是與醫(yī)保政策銜接,,提高用藥可及性,。鼓勵(lì)仿制藥品目錄內(nèi)藥品可按程序優(yōu)先申報(bào)納入國家醫(yī)保目錄。前2批目錄中已有12個(gè)品種通過談判進(jìn)入國家醫(yī)保目錄,。包括罕見病用藥,、治療地中海貧血和乳腺癌等重大疾病的多種藥品,降低患者用藥負(fù)擔(dān),,提高臨床用藥可及,。
五、鼓勵(lì)仿制藥品目錄相關(guān)配套政策
為保障鼓勵(lì)仿制藥品目錄的順利實(shí)施,,國家衛(wèi)生健康委聯(lián)合工業(yè)和信息化部,、國家知識(shí)產(chǎn)權(quán)局、國家醫(yī)保局,、國家疾控局,、國家藥監(jiān)局等部門建立跨部門信息共享,、溝通會(huì)商和協(xié)同創(chuàng)新機(jī)制,推進(jìn)鼓勵(lì)仿制藥品研發(fā),、注冊(cè),、生產(chǎn)、使用,、報(bào)銷等配套政策銜接協(xié)同,。
根據(jù)工作需要,我委將適時(shí)組織相關(guān)單位和行業(yè)學(xué)協(xié)會(huì),、有意愿的市場(chǎng)主體,,加強(qiáng)多方政策溝通、技術(shù)咨詢和工作協(xié)調(diào),,更好支持引導(dǎo)企業(yè)研發(fā),、注冊(cè)和生產(chǎn)臨床需要的高質(zhì)量仿制藥。
(原標(biāo)題:新一批鼓勵(lì)仿制藥品目錄,,39種?。?/p>
【責(zé)任編輯:謝鎮(zhèn)蔚】
【內(nèi)容審核:莊華敏】
24小時(shí)熱聞
相關(guān)閱讀/RELATED READING




